Memahami Ikatan Hidrogen
Hidrogen merupakan unsur yang paling unik, mempunyai atom yang paling ringan dan paling sederhana yaitu 1 proton dan 1 elektron. Hidrogen memiliki kepadatan paling rendah dan bergabung dengan hampir semua unsur reaktif lainnya untuk membentuk senyawa hidrida.
Sifat Hidrogen
Hidrogen mempunyai skala keelektronegatifan sedang sehingga mempunyai sifat yang berbeda-beda, yaitu:
- Membentuk senyawa polar yang sangat elektronegatif (misalnya halogen) dengan muatan positif pada atom hidrogen.
- Tetapi dengan unsur-unsur yang sangat elektropositif (misalnya alkali) mereka membentuk senyawa hidrida ionik dengan muatan negatif pada atom hidrogen. 3). Demikian pula, unsur antara (misalnya karbon) membentuk senyawa non-polar.
- Molekul hidrogen non-polar memiliki titik didih ~20,4 K dan titik beku ~14,4 K akibat gaya van der Waals yang lemah. Biasanya hidrogen berbentuk molekul diatomik.
Sifat kimia atom hidrogen ditentukan oleh 3 jenis proses elektronik, yaitu:
- kehilangan elektron valensi tunggalnya.
Selanjutnya, bagaimana ikatan hidrogen mempengaruhi sifat fisik suatu senyawa?
Ikatan hidrogen tidak hanya mempengaruhi titik didih dan titik leleh suatu zat, tetapi juga mempengaruhi kelarutannya dalam suatu pelarut.
Senyawa yang mengandung ikatan hidrogen mudah larut dalam senyawa lain yang juga mengandung ikatan hidrogen. Misalnya NH3 dalam H2O seperti pada Gambar 11.
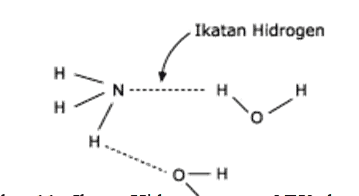
Senyawa organik – alkohol, asam karboksilat, amina, glukosa larut dalam air karena membentuk ikatan hidrogen dengan molekul air.
Senyawa yang memilih ikatan hidrogen akan memilih titik didih yang lebih tinggi dibandingkan molekul yang memilih ikatan van der Waals atau tarikan dipol-dipol. Senyawa hidrida unsur golongan IV, V, dan VI menunjukkan gaya van der Waals yang semakin besar dari atas ke bawah pada masing-masing golongan, sehingga titik didih dan titik lelehnya semakin meningkat, namun kenyataannya sebaliknya.
Senyawa yang mengandung ikatan hidrogen mempunyai titik didih dan titik leleh yang lebih tinggi dibandingkan senyawa lain yang tidak mengandung ikatan hidrogen.
Titik didih H2O lebih tinggi dibandingkan H2S, H2Se dan H2Te. Demikian pula titik didih NH3 lebih tinggi dibandingkan PH3, AsH3, SbH3.
Hal ini tampaknya disebabkan oleh adanya ikatan hidrogen yang kuat antar molekul.
Etanol memiliki titik didih yang jauh lebih tinggi dibandingkan propana meskipun massa molekul relatif (Mr) keduanya tidak jauh berbeda. Hal ini karena molekul etanol memiliki ikatan hidrogen sedangkan propana tidak. Perhatikan rumus struktur etanol dan propana berikut:

Konsekuensi lain dari adanya ikatan hidrogen adalah penyimpanan massa molekul relatif. Seperti asam etanoat (asam asetat) atau dalam kehidupan sehari-hari disebut cuka, yang biasanya terdapat dalam bentuk larutan namun dapat pula ditemukan dalam bentuk gas. Bentuk terakhir ini terjadi karena molekul asam asetat bergabung dengan ikatan hidrogen menghasilkan massa molekul relatif (Mr) sebesar 120, dua kali lipat massa normal 60.
Senyawa yang membentuk ikatan hidrogen antarmolekul memiliki titik didih dan titik leleh yang lebih tinggi dibandingkan senyawa yang membentuk ikatan hidrogen intramolekul. Hal ini karena energi kinetik ikatan hidrogen antarmolekul lebih tinggi dibandingkan energi kinetik ikatan hidrogen intramolekul.
Pengaruh ikatan hidrogen terhadap titik didih, titik leleh dan kelarutan senyawa
Jenis ikatan ini terjadi karena gaya elektrostatis khusus antar dipol. Adanya ikatan hidrogen antarmolekul menyebabkan titik didih senyawa tersebut relatif tinggi dibandingkan senyawa lain yang berat molekulnya sebanding. Senyawa golongan alkohol mempunyai titik didih lebih tinggi dibandingkan senyawa golongan alkana, begitu pula air mempunyai titik didih lebih tinggi dibandingkan aseton.
Pengaruh ikatan hidrogen terhadap titik leleh tidak begitu besar karena jarak antar molekul dalam wujud padat cukup dekat dan yang berperan paling besar terhadap titik leleh adalah berat molekul zat dan kohesi molekul. . Senyawa yang mampu membentuk ikatan hidrogen dalam air akan mudah larut dalam air. Panjang atau pendeknya rantai karbon (gugus alkil-R) mempengaruhi kelarutan senyawa dalam air.
Gambar ikatan hidrogen

Contoh soal
- Tuliskan nama senyawa berikut.
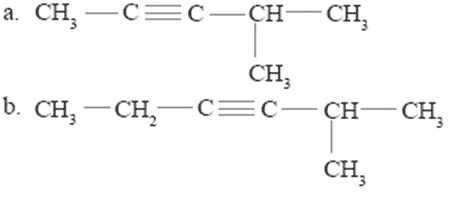
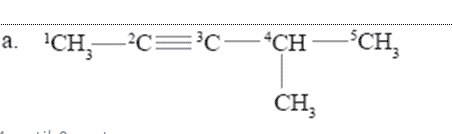
jawab aku.
Demikianlah artikel duniapendidikan.co.id tentang hidrogen yang merupakan unsur paling unik, atom paling ringan dan paling sederhana, semoga artikel ini bermanfaat bagi anda semua.



