Memahami Kesetimbangan Kimia
Kesetimbangan kimia adalah ilmu yang mempelajari semua proses yang dapat terjadi dua arah, yaitu proses atau reaksi yang bersifat reversibel. Keadaan kesetimbangan kimia ditunjukkan pada contoh di bawah ini.
Agustus+ + Fe2+ ↔ Ag + Fe3+
Dua anak panah yang berlawanan arah menunjukkan bahwa reaksi tersebut bersifat reversibel atau terjadi reaksi seimbang. Pada kesetimbangan tidak akan terjadi perubahan makroskopis, yaitu perubahan yang dapat diamati atau diukur, tetapi reaksi berlangsung dengan laju yang sama pada kedua arah. Jadi kesetimbangan kimia bersifat dinamis jika ion Ag+ dan Fe2+ Campuran, laju konversi Ag+ dan Fe2+ Selalu berubah setiap saat.
Jika suatu bahan kimia telah mencapai keadaan setimbang, konsentrasi reaktan dan produk tetap konstan sehingga tidak ada perubahan yang teramati dalam sistem. Namun, seiring dengan berlanjutnya aktivitas molekul, molekul reaktan terus diubah menjadi produk, sedangkan molekul produk diubah kembali menjadi reaktan dengan laju yang sama.
Sangat sedikit reaksi kimia yang berjalan hanya dalam satu arah, sebagian besar merupakan reaksi reversibel. Ketika reaksi reversibel dimulai, reaksi berlangsung ke arah pembentukan produk. Tak lama setelah produk, pembentukan reaktan produk juga dimulai. Jika laju reaksi maju dan mundur sama, maka kesetimbangan kimia dikatakan tercapai. Perlu diingat bahwa kesetimbangan kimia melibatkan banyak zat berbeda sebagai reaktan dan produk. Kesetimbangan antara dua fasa zat yang sama disebut kesetimbangan fisika, perubahan yang terjadi merupakan proses fisika.
Jenis sistem keseimbangan
Keseimbangan seragam
Kesetimbangan homogen adalah kesetimbangan yang hanya terdiri atas satu fasa atau reaksi yang seluruh spesi yang bereaksi berada pada fasa yang sama. Contoh keseimbangan genap adalah:
H2O+I2 ↔2HAI
2JADI2 + HAI2 ↔ 2JADI3
Gas A dan B bereaksi membentuk C dan D. Pada kesetimbangan, laju reaksi untuk membentuk gas C dan D sama dengan laju reaksi untuk membentuk gas A dan B. Reaksi ini dapat direpresentasikan dengan persamaan:
Oh(G) + b(G) ↔ C(G) + d(G)
V1 C dan D. V adalah laju reaksi pembentukan gas.2 A dan B adalah laju reaksi pembentukan gas.
Dalam kesetimbangan:
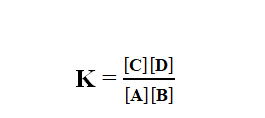
Nilai K ditetapkan pada suhu tertentu. Untuk reaksi pada suhu konstan biasanya dinyatakan dengan persamaan:
mA + nB ↔ pC + qD

Kp = Kc x (RT)∆n
Pada tahun 1884, seorang ahli kimia Perancis, Henri Le Chatelier, menemukan hal ini. Apabila suatu reaksi kimia dalam kesetimbangan mengalami perubahan wujud (menerima aksi luar), maka reaksi tersebut akan berpindah ke kesetimbangan baru dengan pergeseran tertentu untuk mengatasi perubahan yang diterima (sebagai respon terhadap perubahan yang diterima)..
Penerapan Reaksi Kesetimbangan dalam Industri
-
Pembentukan amonia menggunakan proses Haberbosch
Dalam dunia industri, proses Haberbosch misalnya pada produksi amoniak (NH3) merupakan senyawa nitrogen yang sangat penting bagi kehidupan terutama sebagai komponen dalam pupuk dan berbagai senyawa ionik dan senyawa polar. . Amonia dibuat berdasarkan reaksi antara gas nitrogen dan hidrogen.
-
Pembentukan sulfur trioksida (SO3) dalam proses komunikasi
2JADI2(g) + HAI2(g) ↔ 2JADI3(g) + 42.000 kalori
Reaksi ini mirip dengan sintesis amonia, yaitu reaksi yang terjadi bersifat eksotermis dan mengecil volumenya. Untuk menyelesaikan SO3 Paling baik dioperasikan/bereaksi pada suhu rendah, tekanan tinggi, dan gas oksigen atau SO.2 Berlebihan, namun prosesnya tidak ekonomis karena laju reaksinya rendah.
-
Pembentukan Nitrogen Oksida (Proses Birkeland-Ide)
N2 + HAI2(g) ↔ 2NO – 43.250 kal
Reaksi pembentukan NO merupakan reaksi eksotermik, sehingga jika suhu dinaikkan maka kesetimbangan akan bergeser ke arah serapan panas atau reaksi endoterm. Dengan demikian, pembentukan NO akan meningkat seiring dengan meningkatnya suhu. Selain itu, produksi NO meningkat ketika ada gas N.2 Dan HAI2 lagi.
Asam sulfat digunakan dalam industri baja untuk menghilangkan karat pada besi sebelum baja dilapisi dengan timah atau seng. dalam pembuatan pewarna, obat-obatan; Dalam proses pemurnian logam dengan cara elektrolisis; Dalam industri Tekstil, Cat, Plastik, Agregat, Bahan Peledak dll. Singkatnya, jumlah asam sulfat yang digunakan suatu negara telah dijadikan tolak ukur kemakmuran negara tersebut.
Demikianlah artikel dari duniapendidikan.co.id mengenai kesetimbangan kimia yang merupakan ilmu yang mempelajari semua proses yang terjadi pada dua arah, semoga artikel ini bermanfaat bagi anda semua.